Parce que chaque client est unique, nous répondons à vos demandes par des solutions sur-mesure et adaptées à vos besoins.
Notre expertise : La biomécanique et l’imagerie de haute résolution en biologie
Des compétences scientifiques diversifiées et complémentaires dans la caractérisation mécanique et structurelle d’échantillons biologiques :
- Développement de nouvelles approches d’imagerie et de caractérisation en biophysique
- Expertise en biologie cellulaire et moléculaire, biologie cutanée, immunologie
- Optimisation des conditions de mesure, analyses statistiques et reconstruction 3D
- Conception 3D
Un parc d’équipements de haute technologie à la hauteur de vos enjeux
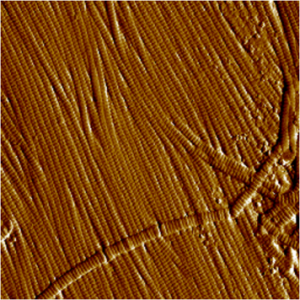
Microscopie de Force Atomique (AFM)
Principe : La microscopie de force atomique (AFM) permet de balayer la surface d’un échantillon grâce à une pointe très fine (1 nm à plusieurs microns de rayon de courbure), positionnée à l’extrémité libre d’un micro-levier flexible. De ce fait, celui-ci peut se déplacer dans toutes les directions de l’espace, grâce à un tube piézoélectrique.
L’analyse des flexions du micro-levier permet de déterminer l’exact parcours de la pointe, la mesure des forces d’interactions intervenant entre elle et l’échantillon, ainsi que les mesure des forces d’indentation. Étant donné sa capacité à définir la topographie de surface, la microscopie de force atomique est parfaitement assimilable à un profilomètre.
Conditions d’utilisation :
- Mesures sur cellules primaires, biopsies, explants de peau, peaux bio-imprimées, reconstruites (morphogenèse, adhésion cellule/cellule, etc.)
- Mesures in situ
- Analyses, cartographie et extraction des caractéristiques mécaniques (module élastique, rigidité, viscoélasticité, adhésion, etc.)
- Spectroscopie (dépliement de protéines, reconnaissance surfacique, etc.)
- Biomatériaux et biotechnologies (ingénierie tissulaire, tests pharmacologiques, etc.)
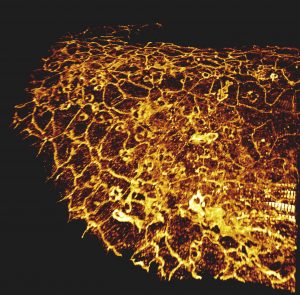
Microscopie d’épifluorescence
Principe : La microscopie d’épifluorescence est une technique de microscopie optique reposant sur le marquage de la molécule d’intérêt par une sonde fluorescente. En ce sens, celle-ci consiste en l’excitation de la molécule fluorescente par un laser (longueur d’onde d’excitation) lui permettant de produire un photon (longueur d’émission) qui sera capté par un capteur (caméra) en revenant à un état stable.
Cette technique permet de mettre en évidence les molécules ou structures marquées dans un échantillon.
Condition d’utilisation : Cette approche est couplée au système de microscopie de force atomique (AFM) afin de repérer les structures à analyser dans un but de positionnement et d’analyse corrélative.
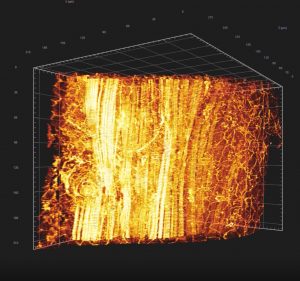
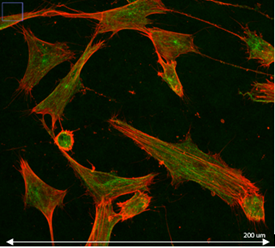
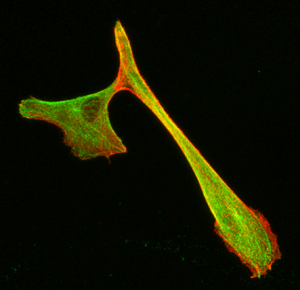
Microscopie confocale
Principe : La microscopie confocale est une technique de microscopie optique permettant de réaliser des images à faible profondeur de champ. Plus précisément, elle est en mesure de réaliser des images sur un seul plan focal d’environ 300 à 400 nm d’épaisseur.
En réalisant des acquisitions d’images de notre échantillon sur différents plans focaux, il est possible d’obtenir une reconstruction tridimensionnelle de celui-ci. Dans ce cas, l’échantillon est balayé par le laser et les photons émis sont captés par un photomultiplicateur.
Conditions d’utilisation :
- Localisation de molécules d’intérêts marquées dans un tissu pluristratifié.
- Organisation cellulaire générale d’un tissu pluristratifié.
- Analyses de colocalisations de molécules marquées.
- Etc.
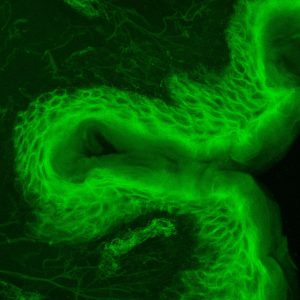
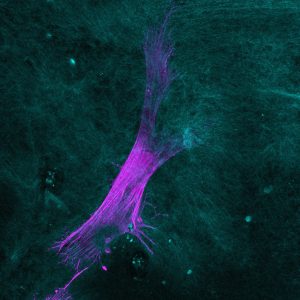
Microscopie par seconde harmonique
Principe : Cette technique utilise un microscope bi photon couplé à un laser pulsé capable d’émettre deux photons de hautes longueurs d’ondes se combinant en un point focal. Grâce à ces hautes longueurs d’ondes, nous pénétrons plus loin dans l’échantillon pour exciter le fluorophore souhaité et nous sommes également en mesure de réaliser des acquisitions d’images en 3D.
De plus, cette technique nous permet l’accès à la génération d’ondes dites de seconde harmonique. Ces ondes sont rendues observables en présence de molécules centrosymétriques (ne possédant pas de centre de symétrie) comme le collagène, présent dans le derme ou la myosine, présente dans les fibres musculaires, …
Conditions d’utilisation :
- Différents types de collagènes.
- Fibres élastiques.
- Muscles
- Etc.
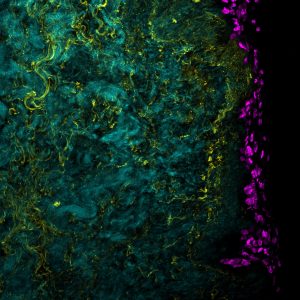
Microscopie à feuille de lumière
Principe : A l’image du microscope confocal, la microscopie à feuille de lumière permet de réaliser des images en trois dimensions à partir de la fluorescence émise par des marqueurs. Cependant, la configuration du microscope se voit ici foncièrement différente. Pour rappel, un microscope confocal se voit doté d’un objectif qui permettra la concentration de la source lumineuse sur l’échantillon mais également la récupération du signal. Dans ce cas, nous nous trouvons avec une configuration perpendiculaire entre la source lumineuse et l’objectif d’acquisition. De plus, c’est notre échantillon qui bougera (z + rotation).
La source lumineuse est adaptée pour fournir l’illumination complète du plan focal à imager. C’est pourquoi, cette illumination est communément appelée feuille de lumière. Certains appareils, comme celui utilisé par BioMeca, possède deux sources lumineuses placées sur un même axe permettant une illumination homogène et optimale de l’échantillon.
Par ailleurs, l’acquisition ne se fait pas par un photomultiplicateur, mais bien par un récepteur à transferts de charge (ou caméra CDD) qui permet de capturer l’intégralité du plan focal très rapidement.
Pour conclure, le réel avantage de cette technique est de pouvoir appréhender des échantillons volumineux par la double illumination de l’échantillon. De plus, elle offre la possibilité de faire tourner l’échantillon, pour avoir des acquisitions selon différents angles et ainsi le reconstruire informatiquement.
Conditions d’utilisation :
- Reconstruction d’échantillons épais
- Analyse d’échantillons épais
- Représentation illustrée d’un phénotype